carboxipeptidaza
definiție
Carboxipeptidazele sunt enzime care împart aminoacizii din proteine sau peptide. Proteinele sunt lanțuri lungi formate din aminoacizi diferiți. Peptidele sunt de asemenea formate din aminoacizi, dar sunt mai scurte. Structura de bază a aminoacizilor este întotdeauna aceeași. Este important să se stabilească conexiunea dintre un atom de carbon și un atom de azot.
Îl puteți vizualiza ca un lanț uman, mâna dreaptă este atomul de carbon, iar mâna stângă este atomul de azot. Unul dintre atomi rămâne liber la fiecare capăt al lanțului. Carboxipeptidazele au despărțit ultimul aminoacid la sfârșitul proteinei, unde atomul de carbon rămâne liber. Se numește așa-numitul capăt C-terminal.
Deoarece enzima nu se poate despica decât la capete, se numește exopeptidază. Pe de o parte, carboxipeptidazele sunt implicate în descompunerea alimentelor ingerate, pe de altă parte, modifică și proteinele produse recent și le aduc în starea lor funcțională.

Ce carboxipeptidase există?
Carboxypeptidasele pot fi împărțite în diferite sisteme. Un sistem împarte carboxipeptidazele în funcție de aminoacizii pe care i-au împărțit în mod preferențial. În acest sistem, carboxipeptidasele sunt împărțite în mai multe grupuri, care sunt desemnate cu litere. Cele mai cunoscute grupuri sunt grupele A și B.
Carboxipeptidasele din grupa A scindează aminoacizii care au o structură ramificată și cei care au un inel aromatic. Aceasta este o structură specială care constă din atomi de carbon și are proprietăți speciale.
Carboxipeptidasele din grupul B au împărțit în mod preferențial aminoacizii care sunt încărcați pozitiv.
Celălalt sistem pentru clasificarea carboxipeptidaselor împarte enzimele în funcție de natura centrului lor activ. Centrul activ denotă punctul de enzimă unde are loc reacția. În cazul carboxipeptidaselor, se face o distincție între metalo-carboxypeptidasele, în care există o moleculă de metal în centrul activ, tiol-carboxypeptidasele, cu aminoacidul cisteină în centrul activ și serina-carboxypeptidase, în care aminoacidul seric se află în centrul activ. Cu toate acestea, diferitele centre active nu determină care aminoacid este împărțit.
Clasa de carboxipeptidase serine este formată din cele trei enzime: Trypsină, chimotripsină, elastază.
Sarcină, funcție și efect
Sarcinile diferitelor carboxipeptidase sunt foarte diverse. În timp ce carboxipeptidasele care au fost descoperite pentru prima dată joacă un rol în digestie, majoritatea carboxypeptidaselor cunoscute astăzi sunt importante pentru alte procese.
Sarcina carboxipeptidaselor în cursul digestiei este de a împărți proteinele în aminoacizi individuali. Acest proces este foarte important, deoarece în intestin nu sunt absorbite proteine, doar aminoacizii individuali.
Carboxipeptidazele sunt indispensabile în procesul de maturare a diferitelor proteine. Pentru ca proteinele să fie pe deplin funcționale după producerea lor, trebuie făcute diverse modificări. De exemplu, aminoacizii individuali sunt împărțiți de carboxipeptidase. Cu toate acestea, această modificare nu are loc doar prin carboxipeptidase, ci în combinație cu alte enzime. Mai mult, carboxipeptidasele sunt implicate în producerea diferitelor peptide.
O peptidă deosebit de importantă este insulina. Diferite carboxipeptidase sunt de asemenea implicate în producerea insulinei.
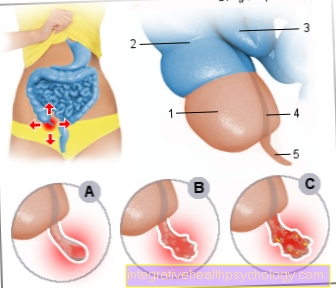
Unde este făcut?
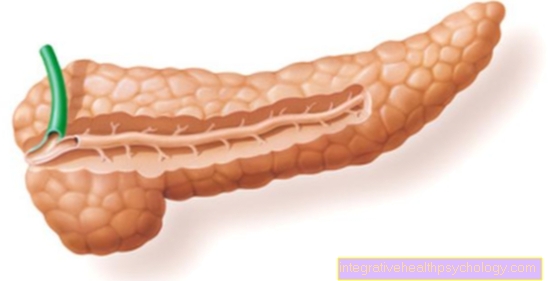
Partea carboxipeptidaselor care este implicată în digestie este produsă în pancreas. Pancreasul, numit și pancreas, produce secreții pancreatice care sunt eliberate direct în intestinul subțire. Această secreție este foarte bogată în enzime. De asemenea, neutralizează conținutul acid al stomacului. Această secreție conține carboxipeptidase care au fost produse anterior în pancreas.
Pentru informații mai detaliate despre ce face pancreasul, citiți articolul nostru: Funcția pancreasului
Ce se întâmplă în caz de deficiență?
Dacă există un deficit de carboxipeptidase, teoretic procesul ar trebui să fie restricționat. Cu toate acestea, nu se știe prea mult despre efectele lipsei de carboxipeptidase, care sunt implicate în digestie. Se presupune că scindarea proteinelor poate fi susținută, deoarece dacă o anumită carboxipeptidază este deficitară, alta poate prelua.
Enzimele au împărțit preferențial aminoacizii respectivi, dar pot, de asemenea, să se despartă de aminoacizii care nu se potrivesc perfect grupului lor. Cu toate acestea, există o boală care se bazează pe o deficiență de carboxipeptidaza N. În această boală, sistemul imunitar este deranjat deoarece această enzimă este implicată în apărarea împotriva bolilor.